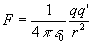Más artículos de Reflexiones
Recordando a Niels Bohr
por Ariadne GALLARDO FIGUEROA
(Ariadne GALLARDO FIGUEROA es Comunicadora Social y Reportera de Radio especializada en entrevistas sobre Ciencia y Tecnología)
¿De qué forma definiría lo que significa átomo? En busca de una explicación sencilla podría concluir con lo siguiente: En el concepto del átomo tenemos nubes de probabilidad energéticas que se proyecta a través y en torno al electrón, el cual gira en torno al átomo, tomando en cuenta que su trayectoria es diversa y dependerá de otros factores, como por ejemplo el principio de incertidumbre, recordemos un poco acerca de este concepto, donde se afirma la imposibilidad de reducir el error en la posición sin incrementar el error en el momento:Niels Henrik David Bohr nació el 7 de octubre de 1885 en Copenhague, Dinamarca.
El físico danés en su juventudFue precisamente un 18 de noviembre del año 1962, cuando falleció el connotado físico teórico Niels Bohr. Hoy le hacemos un breve homenaje puesto que es uno de los intelectuales que destacaron y fueron galardonados con el Nóbel de física en 1922. Al respecto nos habla el doctor en física teórica Aarón Abraham Aguayo González catedrático de la facultad de matemáticas de la Universidad Autónoma de Yucatán y egresado del Cinvestav, unidad Mérida:
Dr. En Física teórica egresado del Centro de Investigaciones y estudios avanzados del IPN,
unidad Mérida, que labora en la Facultad de matemáticas de la Universidad Autónoma de Yucatán aguayo@tunku.uady.mxEl danés Niels Bohr, trabajó en sus inicios con colegas como lo fueron Ernest Rutherford y Thomson, su mayor contribución fue referente a la física del estado sólido, en sus primeros trabajos alrededor del año 1911 habla sobre una nueva visión de ver el átomo, trata de reforzar sus ideas en especial con el átomo de hidrogeno, al separar espectros de energía que no se entendían bien en lo teórico y él propone que el átomo debería visualizarse como un centro masivo, el núcleo; rodeado por electrones que se encuentran girando a través de dicho núcleo masivo en órbitas bien definidas, donde cada una de ellas corresponde a un nivel de energía.
¿Cómo definir estos niveles de energía? Cuando un electrón pasa de un nivel orbital, de una energía E1 a otra de nivel E2, es cuando emite un cuanto de luz, debido a ésta visión Niels logró explicar los fenómenos experimentales en relación al átomo de hidrógeno, posteriormente su teoría tuvo que ser molificada con los descubrimientos que surgen a partir de los años 20’s con la ideas de Planck, Sommerfield y Dirak, sin embargo él, Bohr, es quien da las bases para la nueva interpretación de lo que es en realidad el átomo.Ernest Rutherford no se distanciaba mucho de esta visión, puesto que en sus teorías argumentaba por ejemplo: CON EL descubrimiento del electrón se reveló que el átomo es, paradójicamente, divisible. Quedaba entonces por explicar la estructura del átomo. Con el descubrimiento del núcleo atómico se inició una nueva etapa en la búsqueda de lo elemental: las partículas nucleares. La primera de ellas, el protón, es el núcleo del átomo de hidrógeno y, combinado con neutrones, es constituyente básico de los núcleos del resto de los elementos. Su nombre se deriva de la voz griega para principal o primero (prwtoz) .
Por su parte el físico británico Joseph John Thomson señalaba que la masa del electrón fuese mil veces menor que la del átomo que lo contenía era sólo una de las posibles interpretaciones, que dependía de suponer que la carga del electrón era igual a la unidad electrolítica de carga. Fue entonces necesario determinar experimentalmente, y en forma independiente, la carga y/o la masa del electrón.
Entender los componentes del átomo resultó una ardua tarea, ya que en el pasado se consideraba al átomo como una unidad indivisible entre el protón y el electrón, un cuerpo único e integral, pero la realidad es muy distinta.
Ya que el nivel de energía de estos no es continuo, el electrón debe atravesar por niveles prohibidos de energía, ya que éste solo se moverá en órbitas bien definidas. Por tanto, no podemos dar a los números de energía valores fraccionarios.
¿Qué existe entonces entre un espacio orbital y otro? Lo que se define como energía prohibida, los electrones solamente se encontraban en determinados espacios del átomo, para pasar a diferentes valores de energía, se debería contar con una energía extra, los llamados cuantos; por su contribución recibió en 1922 el premio Nóbel de física. Ahora se utilizan aceleradores de partículas que describen características especiales del átomo, ¿qué nos puede decir al respecto? Los aceleradores de partículas logran visualizar la energía fuerte y débil de los átomos, dependiendo de la energía que se aplique en estos, es posible excitar electrones o partículas que componen el núcleo, asunto que ha llevado a demostrar las características complejas de los átomos.Esa energía de los aceleradores es tal que al golpear electrones estos salen en niveles de energía débil, por su parte la energía fuerte es la que enlaza a todas las partículas fundamentales del núcleo, como son los leptones, quarks y los positrones.
¿En toda esta teoría, donde se centra la discusión entre Einstein y Bohr? La discusión intelectual que se daba entre Albert Einstein y el físico Bohr, se centraba en la forma de energías de los átomos, tomando en cuenta que sus orbitales no son definibles como por ejemplo la órbita de la tierra, ya que no se puede hablar de fuerza gravitacional en un átomo que por sí solo cuenta con una carga cero, pero las fuerzas que movilizan su estructura son coulombicas.Charles Augustin de Coulomb describe un modelo por medio del cual se define la regla de este proceder del átomo, y que dice: cargas diferentes se atraen y similares, se repelen.
Al hacer la teoría Bohr, acepto que tenía que completar el modelo del átomo con fundamentos de la teoría cuántica la cual era insipiente en 1911, cuando se empezaba a visualizar todo este asunto para darle personalidad al átomo.Mediante una balanza de torsión, Coulomb encontró que la fuerza de atracción o repulsión entre dos cargas puntuales (cuerpos cargados cuyas dimensiones son despreciables comparadas con la distancia r que las separa) es inversamente proporcional al cuadrado de la distancia que las separa.
El valor de la constante de proporcionalidad depende de las unidades en las que se exprese F, q, q’ y r. En el Sistema Internacional de Unidades de Medida vale 9·109Nm2/C2.
Obsérvese que la ley de Coulomb tiene la misma forma funcional que la ley de la Gravitación Universal
Darle el carácter que tiene el electrón referente a dualidad onda, partícula, revelaba en el modelo de Bohr, que necesitaba las propiedades de la teoría cuántica.

El átomo se puede caracterizar por espacio vacío, en el centro el núcleo esta cargado positivamente, a su vez el núcleo esta formado por protones y neutrones los cuales están rodeados por una nube de electrones con carga eléctrica negativa
Wermer Heisenberg demostró que no nos será posible idear un método para localizar la posición de la partícula subatómica mientras no estemos dispuestos a aceptar la incertidumbre absoluta respecto a su posición exacta. Es un imposible calcular ambos datos con exactitud al mismo tiempo.
Siendo así, no podrá haber una ausencia completa de energía ni en el cero absoluto siquiera. Si la energía alcanzara el punto cero y las partículas quedaran totalmente inmóviles, sólo sería necesario determinar su posición, puesto que la velocidad equivaldría a cero. Por tanto, sería de esperar que subsistiera alguna “energía residual del punto cero”, incluso en el cero absoluto, para mantener las partículas en movimiento y también, por así decirlo, nuestra incertidumbre. Esa energía “punto cero” es lo que no se puede eliminar, lo que basta para mantener liquido el helio incluso en el cero absoluto.
Un experimento pensado que imaginó Heisenberg nos servirá para ilustrar esta particularidad del microcosmos, donde las operaciones para medir el ímpetu de una partícula microscópica interfieren con las que se deben realizar para determinar su posición. Su razonamiento es el siguiente: cuando observamos una partícula, debemos verla en alguna forma y para ello se requiere iluminarla con luz de frecuencia apropiada. Mientras más pequeña sea la partícula, necesitamos luz de menor longitud de onda y, por lo tanto, de mayor frecuencia. Como E = hv, lo anterior implica usar fotones más energéticos, que deben rebotar en la partícula para luego llegar a nuestro ojo, al microscopio o a cualquier otro detector que empleemos. Por tanto, la velocidad de la partícula sufre cambios siempre mayores, pues la colisión con los fotones cada vez más energéticos la altera más. En otros términos, a medida que deseemos fijar con mayor precisión la posición de una partícula, la medición de su velocidad se torna más imprecisa.
Éste es el contenido básico del principio de incertidumbre, que Heisenberg formuló en 1927: el producto de los errores con que podemos medir posición e ímpetu de una partícula tiene un mínimo, que es inherente a la naturaleza y que está dado por la constante h de Planck.
En 1930, Einstein demostró que el principio de incertidumbre implicaba también la imposibilidad de reducir el error en la medición de energía sin acrecentar la incertidumbre del tiempo durante el cual se toma la medida. Él creyó poder utilizar esta tesis como trampolín para refutar el principio de incertidumbre, pero Bohr procedió a demostrar que la refutación tentativa de Einstein era errónea.
A decir verdad, la versión de la incertidumbre, según Einstein, resultó ser muy útil, pues
significó que en un proceso subatómico se podía violar durante breves lapsos la ley sobre
conservación de energía siempre y cuando se hiciese volver todo al estado de conservación
cuando concluyesen esos períodos: cuanto mayor sea la desviación de la conservación, tanto
más breves serán los intervalos de tiempo tolerables. Yukawa aprovechó esta noción para
elaborar su teoría de los piones. Incluso posibilitó la elucidación de ciertos fenómenos
subatómicos presuponiendo que las partículas nacían de la nada como un reto a la energía
de conservación, pero se extinguían antes del tiempo asignado a su detección, por lo cual eran
sólo “partículas virtuales”. Hacia fines de la década 1940-1950, tres hombres
elaboraron la teoría sobre esas partículas virtuales: fueron los
físicos norteamericanos Julian Schwinger y Richard Phillips Feynman y el
físico japonés Sin-itiro Tomonaga. Para recompensar ese trabajo, se les concedió a
los tres el premio Nóbel de Física en 1965.

Niels Bohr en la madurez de su carrera
Sin duda notamos que es todo un universo el valor y características del átomo y muchísimos científicos en el mundo han creado alternativas para su entendimiento y utilización que cada día acrecienta su valor exponencial, asunto muy gratificante para los tecnólogos y científicos, lo mismo que para todos nosotros que vivimos utilizando artefactos vanguardistas que surgen de los adelantos científicos.
Ariadne GALLARDO FIGUEROA
ariadne.gallardo@yahoo.com
04 diciembre 2004
Más Artículos de Reflexiones