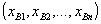Es uno de los conceptos de más trascendencia y utilidad en el quehacer general de la Física. El concepto de temperatura se fundamenta en la idea del equilibrio térmico y en la propiedad de transición que se ha dado en llamar Principio Cero de la Termodinámica.
1. SOBRE LOS SISTEMAS TERMODINÁMICOS.
2. LA TEMPERATURA.
3. ESCALAS DE MEDICIÓN.
4. REFERENCIAS.
1. SOBRE LOS SISTEMAS TERMODINÁMICOS:
1.1. SISTEMASDefiniremos sistema como una parte o región restringida del espacio-tiempo, constituida por materia y/o campos interactuantes, y definiremos también ambiente como la región del exterior del sistema que pueda influir de algún modo sobre su comportamiento.

La descripción de un sistema puede hacerse a gran escala, esto es, mediante magnitudes globales y medibles empíricamente, con muy pocas coordenadas, que denominaremos descripción macroscópica, o bien, puede describirse un sistema mediante hipótesis sobre la estructura material del mismo, utilizando en general magnitudes no medibles empíricamente ni sugeridas por nuestros sentidos y usando para ello un gran número de coordenadas. Este segundo tipo de descripción se denomina descripción microscópica del sistema.
Cuando se estudia macroscópicamente un sistema podemos hacerlo desde sus aspectos externos tales como posición, velocidad, posición del centro de masa, energía potencial, energía cinética, energía total o mecánica, etc., todo con respecto a un sistema de ejes coordenados. Son estas magnitudes las que se miden con lo que llamaremos coordenadas mecánicas. Sus relaciones constituyen la Mecánica.
Pero el estudio macroscópico o microscópico de un sistema puede hacerse desde sus aspectos internos, es decir, se puede dirigir el estudio hacia el interior del sistema, como su energía interna, la presión interna de un gas, la vaporización, etc. Las magnitudes internas se miden con las coordenadas termodinámicas. Sus relaciones constituyen la Termodinámica.
1.2. COORDENADAS INDEPENDIENTES
Una coordenada es independiente de otra si sus valores no dependen de esa otra. Así, si en un sistema termodinámico, un gas por ejemplo, varía el volumen en una determinada escala de valores, aún manteniendo la presión constante, se indica con ello que la presión y el volumen son coordenadas termodinámicas independientes.
Si son
las coordenadas termodinámicas independientes que describen un sistema, indicaremos cada uno de sus estados por un conjunto de valores de dichas coordenadas:
Estado A:
Estado B:
... ... ... ... ... ...
Si consideramos, por simplificar, que el número de coordenadas independientes es solamente de dos, los estados A, B, .... que atraviesa en su evolución un sistema S dado son descritos por pares de coordenadas
que pueden representarse gráficamente en un sistema de ejes coordenados X1X2.
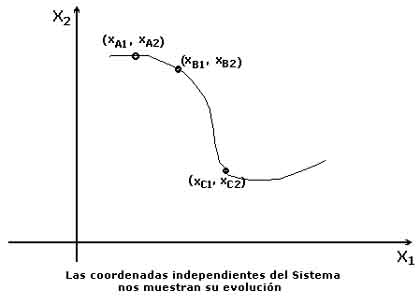
1.3. EQUILIBRIOUn sistema termodinámico de coordenadas independientes (xo,yo) se dice en estado de equilibrio si los valores de dichas coordenadas en ese estado permanecen constantes en el tiempo mientras no sean modificadas las condiciones del ambiente.
En general, el estado de equilibrio de un sistema puede ser alterado por la interacción de otros sistemas ambientales, influyendo en esa alteración tanto la proximidad de dichos sistemas como las paredes de separación.
Las paredes de separación entre sistemas pueden clasificarse en dos tipos extremos: paredes adiabáticas y paredes diatermanas.
Una pared situada entre los sistemas A y B se dice adiabática si los estados (xA,yA) del sistema A y (xB,yB) del sistema B coexisten en equilibrio para valores diferentes de dichas coordenadas. Esto es, si no hay influencia ambiental de un sistema sobre el otro a través de la pared de separación.
En cambio, una pared situada entre los dos sistemas A y B se dice que es diatermana si los estados (xA,yA) del sistema A y (xB,yB) del sistema B cambian espontáneamente hasta que se consigue un estado de equilibrio del sistema global constituido por los sistemas A y B con coordenadas (xA+B,yA+B). Se dice, llegado a ese estado global de equilibrio, que ambos sistemas se encuentra en equilibrio térmico.
En definitiva, se puede definir el equilibrio térmico como el estado al que llegan las coordenadas termodinámicas de dos o más sistemas cuando han estado comunicados mediante paredes diatermanas.
También se puede decir que dos sistemas se encuentran en equilibrio térmico si al comunicarlos mediante una pared diatermana el sistema en conjunto está en equilibrio.
Es inmediato el siguiente enunciado, que se ha dado en llamar Principio Cero de la Termodinámica:
Dos sistemas en equilibrio térmico con un tercero están en equilibrio térmico entre sí.
2. TEMPERATURA:
2.1. ISOTERMASDado un sistema S descrito por dos coordenadas independientes X1X2, se denomina isoterma al conjunto
de los estados que se encuentran en equilibrio térmico con un estado fijo
de otro sistema, y que, por el principio cero de la termodinámica, se encuentran en equilibrio térmico entre sí.
Se comprueba que la representación gráfica de una isoterma en el plano X1X2 es una curva continua.
La magnitud que le hacemos corresponder a todos los estados de una misma isoterma se denomina temperatura. La temperatura resulta ser, por consiguiente, una propiedad que determina sin en un cierto estado A=(xA1, xA2) un sistema S se encuentra en equilibrio térmico con otro estado H=(xH1, xH2) de otro sistema T. El sistema T se denomina termómetro y su utilidad evidente es la de determinar la temperatura del sistema S en el estado A=(xA1, xA2) por comparación con el valor de la temperatura que le asignemos al estado H=(xH1, xH2) del termómetro.

2.2.MEDICIONPara poder medir la temperatura necesitamos establecer una escala de medición, esto es, un conjunto de reglas que nos permitan fijar un origen y una unidad de medida.
El termómetro o sistema medidor presenta asimismo isotermas a las cuales asignamos un número fijo que será la temperatura correspondiente. Para establecer, pues, la temperatura del estado A=(xA1, xA2) de otro sistema S cualquiera que se encuentre en equilibrio térmico con el estado H=(xH1, xH2) del termómetro le asignaremos al estado A el mismo número asignado al estado H.
Para determinar el número que hemos de asignar a cada isoterma del termómetro, hemos de utilizar una magnitud observable, esto es, una magnitud macroscópica que varíe al pasar de una isoterma a otra. Tal propiedad se denomina propiedad termométrica.
Así, por ejemplo, si en un gas se mantiene el volumen constante, podemos observar cómo varía la presión con la temperatura. En este caso, la presión es la propiedad termométrica.
Si es X la propiedad termométrica (suponemos constantes las restantes variables termodinámicas), la temperatura asociada a cada isoterma ha de ser una función sencilla de X, esto es T=f(X).
Un ejemplo, podría ser la función de proporcionalidad directa
que es, realmente, la expresión general más utilizada.
T = k.X [1] Ejemplos de termómetros:
- Gas mantenido a volumen constante. En este termómetro la presión P sería la propiedad termométrica, y en función de la presión se establecería la escala de temperaturas: T = f(P). Si se define la temperatura como proporcional a la presión, será T = k.P.- Gas mantenido a presión constante. La propiedad termométrica es ahora el volumen V. Se tiene que T= f(V), o bien, usando la proporcionalidad, T = K.V
- Resistencia eléctrica de un circuito cuando están fijas la tensión y la intensidad de corriente. La temperatura se establece como T = f(R). O bien, T = k.R
- Tubo de mercurio. La propiedad termométrica es la longitud L de la columna de mercurio. La temperatura se mide por una función simple de la longitud T=f(L). Y T = K.L
2.3. PUNTO FIJOEs inmediato que resultan escalas en general diferentes cuando la relación [1] se aplica a cualquier sistema termométrico con el mismo valor de la constante k de proporcionalidad. El primer problema que se plantea, pues, es encontrar alguna regla o norma que nos permita establecer el valor de la constante k de proporcionalidad para cada propiedad termométrica.
El procedimiento que se utiliza consiste en buscar un estado en la naturaleza, denominado punto fijo, que sea fácilmente reproducible y asignarle una temperatura patrón Tt.
Esto quiere decir que si tenemos un termómetro TX de propiedad termométrica X, el valor Xt de dicha propiedad en el punto fijo obedece la relación:
Tt = k.Xt Y de aquí deducimos que, para esta propiedad termométrica, es
K=Tt/Xt Por tanto, en el termómetro TX la temperatura T que corresponde al valor X de la propiedad termométrica sería:
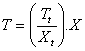
Hasta el año 1954 se utilizaban dos puntos fijos, que eran el de fusión del hielo y del de ebullición del agua. Pero a partir de ese año se utiliza como único punto fijo el llamado punto triple del agua, que es el estado del agua pura en el cual existe en equilibrio una mezcla de sólido, líquido y gas. Se le asigna al punto triple del agua el valor 273,16 con el objeto de que la escala resultante sea lo más parecida posible a la anterior a 1954.
Así, para los ejemplos de termómetros indicados antes, se tendría:
a) Para el gas a volumen constante:b) Para el gas a presión constante: 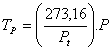
c) Para la resistencia eléctrica: 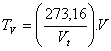
d) Para el tubo de mercurio: 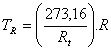

Experimentalmente se comprueba que al medir la temperatura con cada uno de estos tipos de termómetro, se obtienen resultados bastante diferentes, e, incluso, para el caso de los termómetros de gas (ya sea el de volumen constante, o bien el de presión constante) se obtienen resultados diferentes según sea el tipo de gas que se emplee en la construcción del termómetro. Si bien es verdad que la discrepancia menor se encuentra en la utilización de estos termómetros de gas, encontrándose la mayor similitud entre los termómetros de Hidrógeno y de Helio a volumen constante.
3. ESCALAS DE MEDICIÓN:
3.1. LA ESCALA DE LOS GASES PERFECTOSHay un hecho experimental de extraordinaria importancia que nos permite construir una escala que se ha dado en llamar de los gases perfectos. Este hecho experimental consiste en que todos los termómetros de gas, ya sea a presión constante o a volumen constante, tienden a dar la misma medida de la temperatura en cuanto se hace tender a cero la propiedad termométrica en el punto triple del agua, sea cual fuere el gas empleado como termómetro.
Es decir, en un termómetro de gas a volumen constante, en donde la temperatura se calcula mediante la expresión 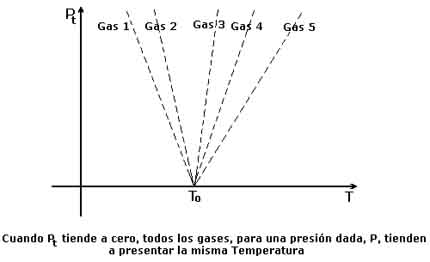
Para cualquiera que sea el gas que se emplee permanece fija y única la temperatura dada por la expresión 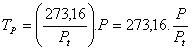
Y para el termómetro de gas a presión constante: 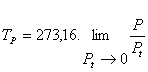
Se define, en definitiva, la temperatura en la escala de los gases perfectos por la expresión 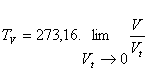
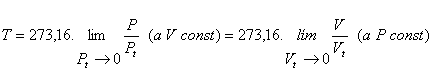
Sin embargo, aún cuando la temperatura medida en esta escala no depende de ningún gas en particular, si depende de las propiedades generales de los gases. Así, es imposible llegar a medir una temperatura T = 0, pues no hay ningún gas con el que podamos construir un termómetro para poder medir una temperatura tan baja (de hecho, la temperatura más baja a medir en esta escala es la que permite usar un termómetro con Helio a mínima presión, y es algo así como un kelvin).
Se hace necesario en definitiva, encontrar una escala en la que no se dependa de propiedades generales de ninguna sustancia. Esto se consigue con la escala Kelvin.
3.2. LA ESCALA KELVIN O ABSOLUTAAdoptada en 1848 por William Thomson, Lord Kelvin (1824-1907). En el intervalo de temperaturas en donde sí es posible la utilización de un termómetro de gas, la escala de los gases perfectos y la escala Kelvin son idénticas.
Para definir la Escala Kelvin es preciso estudiar el Ciclo de Carnot. Resumidamente, por razones de espacio, solo indicaremos brevemente que lo que caracteriza a un Ciclo frigorífico de Carnot es que las magnitudes dadas por la cantidad de calor absorbido, la cantidad de calor cedido y el trabajo realizado en el recorrido del Ciclo se mantienen exactamente iguales que cuando el Ciclo se desarrolla en sentido inverso.
En estas condiciones, se define el cociente de dos temperaturas Kelvin, T1 y T2 como el cociente de los valores absolutos del calor cedido y absorbido por un motor de Carnot que funcione entre dos focos caloríficos a dichas temperaturas. O sea: 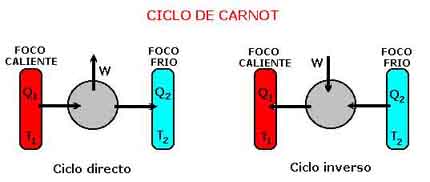
Si asignamos, al igual que en la escala de los gases perfectos, el valor de 273,16 a la temperatura del punto triple del agua, se puede escribir: 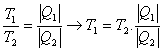
Resulta, pues, que en esta escala de medición, la cantidad de calor, Q, es la propiedad termométrica. 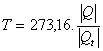
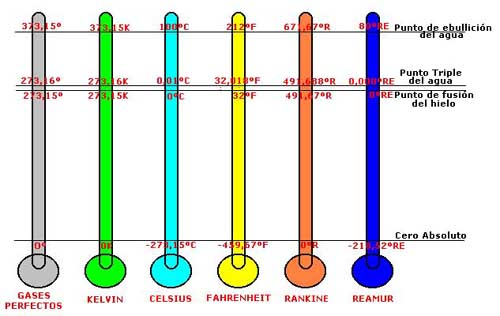
Se encuentra así, en definitiva, que en la escala de los gases perfectos, lo mismo que en la escala Kelvin, el punto de fusión del hielo está a 273,15 kelvin, el punto de ebullición del agua queda en 373,15 Kelvin, y la temperatura del punto triple es, como ya hemos indicado, 273,16 kelvin.
O sea:
Escalas Kelvin y de los Gases perfectos Punto triple del agua 273,16k y 273,16º Punto de fusión del hielo 273,15k y 273,15º Punto de ebullición del agua 373,15k y 373,15º
Lord Kelvin
3.3. LA ESCALA CELSIUSPropuesta por el astrónomo sueco Anders Celsius (1701-1744). Esta escala se define con un grado de la misma amplitud que las escalas Kelvin y de los Gases Perfectos, pero estableciendo su origen en el punto de fusión del hielo, o sea, mediante la relación con la temperatura kelvin de la forma:
con lo cual: 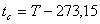
Temperatura Celsius del punto Triple del agua: tc = 273,16-273,15=0,01ºC
Temperatura Celsius del punto de fusión del hielo: tc = 273,15-273,15=0,00ºC
Temperatura Celsius del punto de ebullición del agua: tc = 373,15-273,15=100,00ºC
Escala Celsius Punto triple del agua 0,01ºC Punto de fusión del hielo 0,00ºC Punto de ebullición del agua 100,00ºC
Anders Celsius
3.4. LA ESCALA FAHRENHEITEsta escala, propuesta por el germano-polaco Daniel Gabriel Fahrenheit (1686-1736), difiere de las anteriores en la amplitud del grado y también en el origen. Puede relacionarse la temperatura Fahrenheit con la temperatura Celsius mediante la expresión
Se tiene: 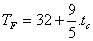
Temperatura del punto triple del agua: TF = 32+9/5. 0,01 = 32,018ºF
Temperatura del punto de fusión del hielo: TF = 32+9/5. 0,00 = 32,00ºF
Temperatura del punto de ebullición del agua: TF = 32+9/5.100 = 212,00ºF
Escala Fahrenheit Punto triple del agua 32,018ºF Punto de fusión del hielo 32,00ºF Punto de ebullición del agua 212,00ºFs
Daniel G. Fahrenheit
3.5. LA ESCALA RANKINEIdeada por el escocés William John Mcquorun Rankine (1820-1872), se relaciona con la escala Celsius mediante la expresión:
Se tiene: 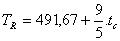
Temperatura del punto triple del agua: TR=491,67 + 9/5 . 0,01 = 491,688ºR
Temperatura del punto de fusión del hielo: TR=491,67+9/5. 0,00 = 491,67ºR
Temperatura del punto de ebullición del agua: TR=491,67+9/5. 100,00 = 671,67ºR
Escala Rankine Punto triple del agua 491,688ºR Punto de fusión del hielo 491,67ºR Punto de ebullición del agua 671,67ºR
W. J. Rankine
3.6. LA ESCALA REAMURSe debe a René-Antoine Ferchault de Reamur (1683-1757). La relación matemática con la temperatura Celsius viene dada por
Temperatura del punto triple del agua: TRE=4/5 . 0,01 = 0,008ºRE 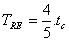
Temperatura del punto de fusión del hielo: TRE=4/5. 0,00 = 0,00ºRE
Temperatura del punto de ebullición del agua: TRE=4/5. 100,00 = 80,00ºR
Escala Reamur Punto triple del agua 0,008ºRE Punto de fusión del hielo 0,00ºRE Punto de ebullición del agua 80,00ºRE
René-Antoine Reamur
3.7. COMPARACIÓN DEL ALGUNAS TEMPERATURAS ENTRE LAS DIFERENTES ESCALAS
4. REFERENCIAS:
ADKINS, C.J., Thermal Physics. Cambridge University Press, 1987
ENCICLOPEDIA ENCARTA.
WEBER, ROBERT, Física para matemáticas e ingeniería, Mc Graw Hill, 1987
ZEMANSKY, MARK W., Heat and Thermodynamics, Mc Graw Hill, 1968
ZEMANSKY, M. W.-VAN NESS, H.C. Termodinámica Técnica Fundamental, Aguilar, S.A. de Ediciones, 1972
Carlos S. CHINEA
casanchi@teleline.es
31 enero 2004
Otros artículos de Física