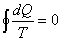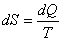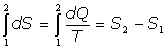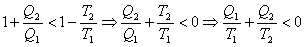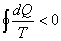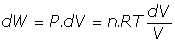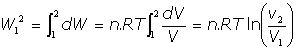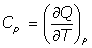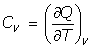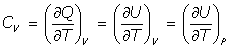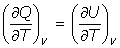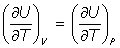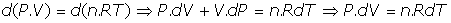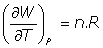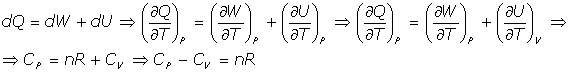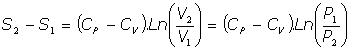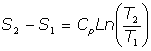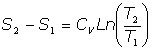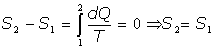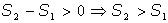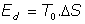Más Artículos de Física
ENTROPÍA Y DEGRADACIÓN DE LA ENERGÍA
La Termodinámica afirma que el Universo morirá. La energía se degrada y la entropía aumenta. Cuando ya no quede energía utilizable y la entropía no pueda aumentar más, el Universo habría muerto en un inconcebible desorden, en un inimaginable caos.
El Principio Cero de la termodinámica establece la transitividad del equilibrio térmico, mientras que el Primer Principio afirma el cumplimiento del Principio de Conservación de la Energía y la equivalencia de ésta con el calor en todos los procesos termodinámicos, a la par que el Segundo Principio nos muestra cómo son solo posibles en la naturaleza ciertos procesos y no son posible otros.
Los procesos que espontáneamente tienen lugar en un sistema termodinámico aislado son siempre irreversibles, y, considerando a todo el Universo como un sistema termodinámico aislado, podemos afirmar que en la naturaleza todos los procesos son irreversibles.
Sin embargo, en todos los procesos espontáneos se dan dos tipos de características trascendentales: una parte de la energía puesta en juego deja de ser utilizable, no puede ponerse en juego en procesos posteriores, y, por otra parte, en todos los procesos naturales se pasa de un estado con cierto orden a un estado de mayor desorden, en el sentido, pues, de aumentar el caos.
Los procesos naturales, espontáneos e irreversibles, tienden al aumento de desorden y a la disminución de energía utilizable. Es la tendencia natural hacia el desorden y el caos mientras se degrada la energía. Se hace necesaria alguna magnitud que permita la descripción de esta situación de tendencia de los procesos naturales en todo el universo como sistema aislado.
Hablemos aquí de la Entropía como medida de la degradación energética.
Procesos reversibles y entropía
Un proceso es termodinámicamente reversible cuando en cualquiera de los puntos de su evolución puede ser invertido el sentido de mismo, con modificación infinitesimal de las condiciones externas. Esto tiene lugar si todas las funciones de estado varían con infinita lentitud, manteniéndose el estado de equilibrio del sistema en todo momento. Es inmediato que los procesos verdaderamente reversibles son de carácter ideal pues tendrían siempre lugar en un tiempo infinito. Los procesos reales, los procesos que verdaderamente se desarrollan en la naturaleza, son siempre termodinámicamente irreversibles.
En un sistema cerrado, los procesos espontáneos son aquellos que se desarrollan por si mismos, sin la intervención de ningún agente exterior. Cuando intervienen influencias exteriores al sistema se dice que se trata de un proceso termodinámico no espontáneo. El Segundo Principio de la Termodinámica establece la irreversibilidad de todos los procesos espontáneos.
Del Teorema de Clausius para procesos cíclicos reversibles sabemos que es
Donde dQ no es diferencial exacta, por lo que 1/T es el factor integrante.
Esto permite la introducción de una magnitud S de modo que, es decir, de modo que dS sí es diferencial exacta.
Se tiene, en definitiva, que
[0] La variación de S entre dos estados conectados mediante un proceso reversible no depende, pues, del camino seguido, por lo que
Queda introducida, pues, la noción de entropía como una función del estado del sistema termodinámico cuya diferencial verifica la condición [0].
La entropía y los procesos irreversibles
Mediante la adecuada generalización de la igualdad de Clausius podemos extender la noción de entropía a los procesos irreversibles, pues del conocido resultado (ver Teorema de Clausius en esta misma web) de que un ciclo reversible posee mayor rendimiento que cualquier otro ciclo irreversible que opere entre las mismas temperaturas, resulta:
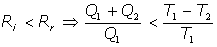
(considerando)
De lo cual:
y esto se puede generalizar a un proceso cíclico irreversible cualquiera de la misma forma que se generaliza el Teorema de Clausius a estos procesos
[1] Es decir, resumiendo lo anterior, puede afirmarse que en toda evolución cíclica se verifica que
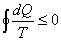
Quedando englobados aquí tanto los casos de reversibilidad como los de irreversibilidad.
Un ejemplo de determinación de la entropía en procesos reversibles (ideales): las transformaciones termodinámicas de los Gases perfectos
Veamos en este apartado cómo varía la entropía cuando en un gas perfecto realizamos algún proceso de transformación reversible (ideal) característico de estos sistemas, a saber, transformaciones de tipo isotermico, isocoro, isobarico o adiabático.
A) Gases Perfectos:
Repasemos previamente algunas nociones, relaciones y definiciones básicas de la Teoría de los Gases Perfectos:
- Ecuación general: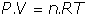
- Expresión diferencial de Primer Principio de la Termodinámica:, siendo U= U(T) la energía interna del gas.
- Trabajo de expansión en un gas:(a) En forma diferencial:
(b) En forma integral:
(c) Si es a temperatura constante: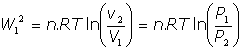
- Capacidades caloríficas:
(a) A Presión constante:
(b) a volumen constante:
(c) Se cumple la relación:
pues se cumple que a V= constante, dW=0 (no hay trabajo de expansión), y del Primer Principio de la Termodinámica: dQ = dU, por lo que es
y por ser la energía interna U función solamente de la temperatura U = U(T), se tiene que
- Trabajo a presión constante:
(a) En forma diferencial total
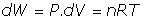
pues diferenciando en la ecuación de los gases perfectos:
(b) La diferencial parcial con respecto a la temperatura:
- Relación de Mayer de las capacidades caloríficas:
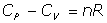
pues por ser:
- Relación de las capacidades caloríficas con la presión y la temperatura:
[2]
pues
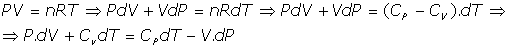
B) Entropía de las transformaciones:
- Transformaciones isotérmicas:
Son las transformaciones a temperatura T constante, y como la energía interna del gas es solo función de la temperatura, en estas transformaciones la variación de energía interna es cero:
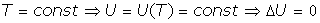
Y del Primer Principio de la Termodinámica:
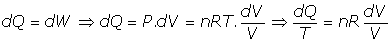
por tanto:
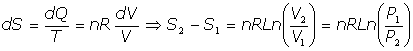
y, utilizando la relación de Mayer entre las capacidades caloríficas, podemos escribir:
- Trasformaciones isobáricas:
Se trata de las transformaciones a presión P constante, es decir, dP=0.
Del Primer Principio, se tiene:
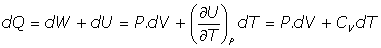
y utilizando la relación [2]:
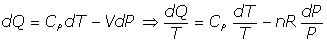
De ser dP=0, se tiene:
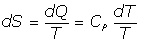
Y, en definitiva:
- Transformaciones isocoras::
Son las transformaciones termodinámicas a volumen constante (dV=0). Se tiene:
Del Primer Principio, se tiene: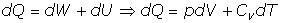
y, por ser dV=0, se tendrá:
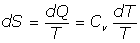
por tanto:
- Transformaciones adiabáticas:
En estas transformaciones es dQ=0, lo que implica que dS=0, esto es:
es decir, se trata de transformaciones de entropia constante, o transformaciones isentrópicas.
Sobre el aumento de entropía
Si consideramos un ciclo irreversible compuesto por un tramo 1->2 irreversible y otro tramo 2->1 reversible podemos establecer el hecho de que la entropía aumenta.
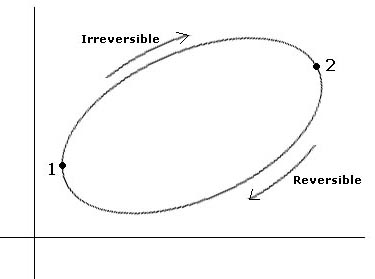
Si aplicamos la expresión [1], se tiene:
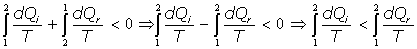
de acuerdo con la definición de entropía, es:
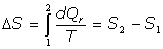
por tanto:
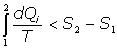
Si consideramos un sistema térmicamente aislado, será dQi=0, por lo que
En definitiva, la entropía de un sistema aislado aumenta a lo largo de cualquier proceso irreversible.
Si consideramos todo el universo como un sistema aislado, la entropía del universo aumenta, pues todos los procesos son irreversibles.
Se puede concluir que:
Los sistemas físicos aislados, que no reciben energía desde el exterior, tienden al desorden, al aumento de entropía, a la desorganización, al caos.
Cuando un sistema no está aislado, cuando recibe desde el exterior energía, ya sea en forma de trabajo, ya sea en forma de calor, el sistema tiende a autoorganizarse, a ordenarse, a la disminución de su entropía, en procesos que son contrarios a los procesos naturales regidos por el segundo principio de la termodinámica.
Sobre la degradación de la energía
Del Teorema de Carnot se tiene que para un motor cualquiera M su rendimiento R'e es inferior al rendimiento Re de Carnot:
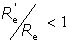
Este cociente, pues, es menor que la unidad y se denomina factor de calidad del motor M:
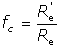
El trabajo desarrollado por un motor cualquiera M, de factor de calidad fc, funcionando entre dos focos de temperatura T1 y T2 es, cuando absorbe una cantidad de calor Q1, de la forma:
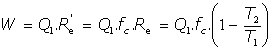
de lo que deducimos que el máximo trabajo aprovechable en cualquier proceso será el debido al funcionamiento del motor de Carnot:
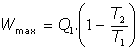
Esta expresión representa, en definitiva, la máxima cantidad de trabajo que puede obtenerse desde la cantidad de calor Q1 suministrada al motor que funciona entre las temperaturas indicadas.
Para ver que se produce degradación energética, esto es, que una parte de la energía deja de ser utilizable cuando se realiza un proceso irreversible, supongamos un motor de Carnot que funcione entre un foco caliente de temperatura Ti y la temperatura ambiente T0 que sería el foco frío, produciendo un trabajo Wi, tal como se muestra en la siguiente figura.
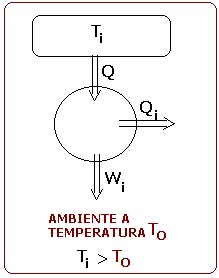
Si ahora se produce un proceso irreversible por el cual el foco a temperatura Ti cede la cantidad de calor Q a otro foco de temperatura intermedia Tf, para que trabaje el motor de Carnot desde ese otro foco de temperatura Tf, se tiene:
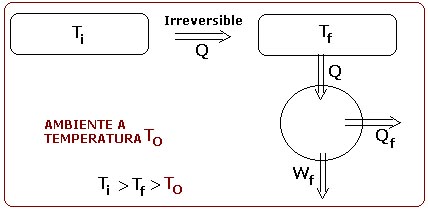
En definitiva, se tiene que el trabajo producido en ambos casos es:

Siendo, por tanto, Wi > Wf (pues Ti > Tf).
Habiendo dejado de ser utilizable, por tanto, una parte de la energía, igual a la diferencia de ambas.
Veamos como evaluar la energía, Ed, que se ha degradado, que ha dejado de ser utilizable en el proceso irreversible:
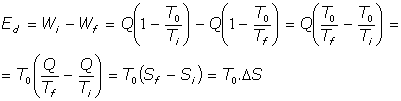
Energía no utilizable:
Resulta, en definitiva, que la variación de entropía en el proceso irreversible es el factor que, multiplicado por la temperatura ambiente, evalúa el total de energía que se degrada en el proceso.
Bibliografía:
Callen, H.B., "Thermodynamics and an introduction to thermostatistics". John Wiley & Sons, USA (1985)
Zemansky, M.W., "Calor y Termodinámica", McGraw-Hill, México (1990)
Carlos SANCHEZ CHINEA
casanchi@teleline.es
Más Artículos de Física