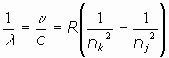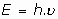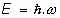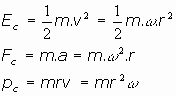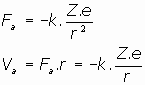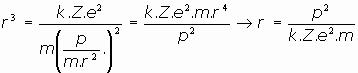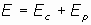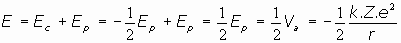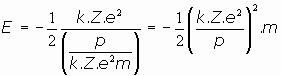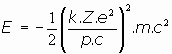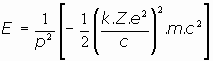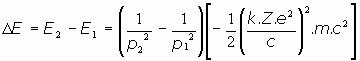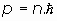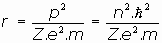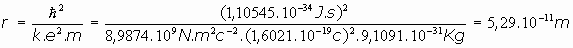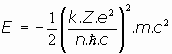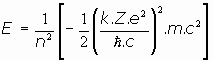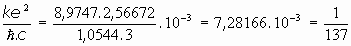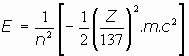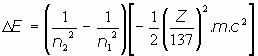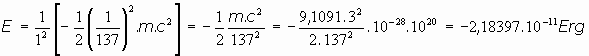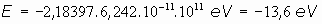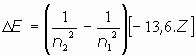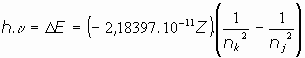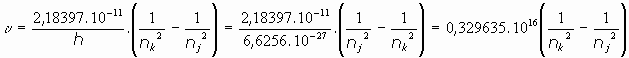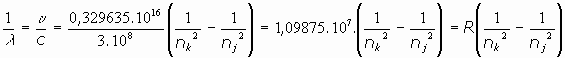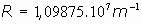Más artículos de Física
Niels Bohr, o el comienzo de la aventura
En nuestra época, cuando está ya consolidado un modelo estandard para la física de las partículas,
cuando hablamos de quarks y de leptones como las partículas fundamentales de la materia, cuando hablamos de
que también son partículas fundamentales las partículas portadoras de las fuerzas gravitatoria (aún no
evidenciadas, por cierto), de las electromagnéticas, de la fuerza débil y de las llamadas fuerzas
fuertes. Cuando hablamos, en definitiva, de gravitones, de fotones, bosones Z, W y W+, mesones y gluones,
no podemos menos que dirigir nuestra vista atrás, hacia los comienzos de la gran aventura, en los
primeros años del siglo XX, cuando los físicos se embarcaban en la epopeya de desentrañar la
estructura real de la materia, de encontrar lo fundamental, lo elemental, de encontrar en definitiva el modelo que debía seguir
la estructura del átomo.
Niels Bohr (1885-1962) tuvo un papel crucial al definir un modelo estable del átomo bosquejado antes por
Ernest Rutherford (1871-1937), sobre trabajos pioneros de Josph J. Thomson (1856-1940) y de lo que
entonces se comenzó a llamar "la hipótesis de Planck" (Max Planck,1858-1947).
1. La situación.




2. El diseño clásico de Rutherford.
3. La cuantización introducida por Bohr.
1. LA SITUACIÓN:
En los primeros años del siglo XX fué cuando empezaron las experiencias básicas que crearían toda la teoría cuántica del átomo. Existían desde 1887 algunos problemas que la física teórica de la época no podia explicar, tales eran, por ejemplo, el llamado Efecto Fotoeléctrico y lo que se dió en denominar "catástrofe del ultravioleta".
Digamos sobre el Efecto Fotoeléctrico que se descubrió, en efecto, que la descarga entre dos electrodos se inicia más fácilmente si sobre el cátodo se hace incidir radiación (Henrich Hertz, en 1886). En 1900 Lenard probó que la radiación, al incidir sobre el metal del cátodo arrancaba electrones, que son los que realmente aceleran la descarga. La distribución de las energías cinéticas de estos electrones arrancados al metal presentaba, sin embargo, un máximo que era independiente de la intensidad de la fuente de la radiación, lo cual entraba en conflicto con la mecánica clásica, que consideraba realmente a la radiación exclusivamente como ondas. Este es el efecto fotoeléctrico, que trajo de cabeza a los físicos de principios de siglo, hasta la interpretación de Einstein en 1905.
En lo que respecta a la catástrofe del ultravioleta, digamos que no coincidía con las observaciones el espectro que la termodinámica clásica calculaba para la energía emitida por un objeto incandescente. Según la teoría clásica, la radiación ultravioleta emitida por el objeto, acompañada de rayos X, habría de ser infinita, cosa que, evidentemente, no ocurría.
Buscando lo más pequeño
Joseph J. Thompson ocupó el sitio que habia dejado James Clark Maxwel en el laboratorio Cavendish de la universidad británica de Cambridge. Realizó una experiencia fundamental: cuando una corriente eléctrica pasa a través de un gas enrarecido, entonces un electrodo negativo produce los rayos catódicos. Thompson pudo probar que las partículas que constituían los rayos catódicos eran partículas con carga electrica, a las que llamó "electrones". Pensó que los electrones eran arrancados a los átomos por el impacto de los iones del tubo de descarga sobre el electrodo negativo. Eran, pues, los electrones algo más pequeño que los átomos y, además, eran parte de los mismos.En 1896, Henri Becquerel (1852-1908) había descubierto la radioactividad, en la que trabajarían entonces los Curie. El mismo Rutherford ayudó a clasificar la radiación en partículas alfa, beta y gamma. Se sabia ya, pues, que eran algo más pequeño que el átomo. Se sabia, por ejemplo, que las partículas alfa eran iones de helio que emergían a gran velocidad.
El centro del átomo ha de ser masivo
El siguiente paso en la investigación de la estructura atómica correspondió a Ernst Rutherford, que se dedicó a bombardear con partículas alfa finísimas láminas de metal con la esperanza de que tales láminas absorvieran la totalidad de la radiación. Sin embargo, y asombrosamente para Rutherford, muchas de las partículas alfa "rebotaban" en todas direcciones. Algunas, incluso, dirigiendose hacia la fuente de emisión, hacia el cañón que las habia disparado.Durante algún tiempo no supo Rutherford explicar lo sucedido, hasta su frase de "ya sé a qué se parece un átomo". Y lo que dedujo fué, sencillamente, que practicamente toda la masa del átomo habría de estar concentrada en un núcleo muy pequeño, mientras los electrones orbitan alrededor del mismo, como los planetas de nuestro sistema solar orbitan alrededor del sol. Con este modelo pudo explicar perfectamente los ángulos con los que salian desviadas las partículas alfa lanzadas sobre la placa metálica de sus experimentos.
El nuevo problema
Ya existían, como hemos indicado antes, el problema de explicar el efecto fotoeléctrico, o la "catástrofe del ultravioleta" donde fallaba ostensiblemente la termodinámica clásica, pero la interpretación de Rutherford de un modelo planetario para los átomos era algo inconcebible a la luz de la fisica de la época.Pues ya las ecuaciones de Maxwell indican muy claramente que los electrones al girar alrededor del núcleo, y habida cuenta de su aceleración centrípeta, han de perder energía en forma de radiación electromagnética. Esto quiere decir que el electrón acabaría estrellándose contra el masivo núcleo del átomo, y, por tanto, éste sería inestable.
Aparte de esto, se sabía también que el átomo solamente podía absorver o emitir ciertas frecuencias de radiación, pero no otras. En realidad, las líneas espectrales de prácticamente todos los elementos habían sido medidas con bastante precisión, constituyendo un banco de datos que no se acertaba a explicar teóricamente.
Así, Rydberg (Johannes Robert Rydberg, 1854-1919) había descubierto que la longitud de onda,
, de la radiación emitida por un objeto incandescente estaba relacionada con dos lineas,
, y
, de su espectro de emisión, mediante la fórmula
donde es
la "constante de Rydberg", obtenida empíricamente y que la física de la época no podía explicar.
La mecánica clásica, pues, no podía explicar el porqué de que el átomo de Rutherford fuera estable, esto es, de que pudiera existir realmente. Ni tampoco explicaba porqué solamente ciertas frecuencias de radiación electromagnética podían ser absorvidas o bien emitidas por las estructuras atómicas. El problema que habia originado el diseño del átomo de Rutherford se añadía inexorablemente a los del efecto fotoeléctrico, catástrofe del ultravioleta, etc., y comenzaba a calar en el ambiente científico y universitario la idea de que la Física no era algo acabado, terminado, como habian pensado tan alegremente muchos físicos de finales del siglo XIX.
La hipótesis de Planck
El problema de la radiación emitida o absorvida fué estudiado por Max Planck, intentando encontrar una relación entre la distribución del espectro de radiación de un cuerpo y su temperatura. En 1900 encontró que la energía de la radiación electromagnética absorvida o emitida tenía relación, asombrosamente, con la frecuencia de la misma radiación.Llegó a concluir, sin poder justificar la razón, que la energía electromagnética emitida o absorvida solo podría serlo en cantidades que fueran proporcionales a la frecuencia
de la radiación.
o bien, a la velocidad angular,
, en radianes por segundo:
siendo:
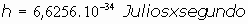
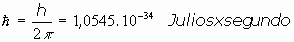
2. EL DISEÑO CLÁSICO DE RUTHERFORD:
La estructura que habría de tener el átomo, según dedujo Ernst Rutherford desde sus experimentos de bombardeo de finísimas láminas metálicas con partículas alfa, habría de ser algo muy parecido a un sistema planetario, en donde el núcleo atómico, que contendría casi toda la masa del átomo, sería la estrella alrededor de la cual orbitarían los electrones, planetas. La fuerza de atracción culombiana del núcleo sobre cada uno de los electrones orbitantes indicaría que el núcleo posee carga electrica positiva, de magnitud, Z, igual al número total de electrones, negativamente cargados, en órbita circular a su alrededor, a fin de que hubiera el necesario equilibrio eléctrico.
El problema es que, según esto, el átomo habría de ser inestable, pues la emisión de energía por los electrones en su movimiento alrededor del núcleo les haría estrellarse sobre el mismo, de la misma manera que también los planetas y otros objetos que orbitan alrededor de una estrella tienden al impacto sobre la misma en un tiempo más o menos largo.
El análisis matemático de este diseño atómico es muy sencillo.
Las magnitudes clásicas del electrón en su movimiento circular alrededor del núcleo son:
La fuerza electrica de atracción que expresa la ley de Culomb nos da, para la fuerza y el potencial electrostático:
Podemos intentar despejar el radio de la orbita de cada electrón, así como su energía
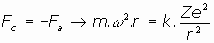
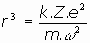
al no conocerse la velocidad angular,
del electrón, resulta más conveniente escribir esta expresión en función de alguna magnitud medible, como el momento angular:
Esta sería, pues, la expresión del radio de la órbita del electrón en el modelo atómico de Rutherford. Veamos también la energía total del electrón:
y, aplicando el teorema del Virial para partículas en movimiento circular (
), se tiene:
Si sustituimos ahora la expresión del radio obtenida en función del momento angular del electrón:
O bien, expresando la energía como proporcional a m.c2, energía relativista de la radiación:
o también se puede escribir explicitando el momento angular, de la forma:
Esta, en definitiva, la energía total de un electrón en orbita circular alrededor del núcleo, donde es Z.e la carga electrica total, siguiendo una órbita cuyo momento angular es p.
La diferencia de energía entre dos órbitas de momentos angulares p1 y p2, resulta ser:
Desde el punto de vista de la mecánica clásica, ya no se podía avanzar más. No se conocía la expresión del momento angular del electrón, ni se tenía idea de con qué magnitudes relacionarlo, persistiendo el hecho de la inestabilidad de todo el diseño, no explicado teóricamente. En esta situación se produjo la aportación de Niels Bohr en 1913.
3. LA CUANTIZACIÓN INTRODUCIDA POR BOHR:
Bohr llegó rápidamente a la conclusión de que los problemas que aparecían en el modelo de Rutherford habrían de dilucidarse desde perspectivas distintas al enfoque de la mecánica clásica.
Los postulados
Para salir de la situación de bloqueo que representaba el modelo de Rutherford, Niels Bohr supuso que se habrían de cumplir algunas premisas básicas, sin que supiera exactamente la razón. Estos fueron los hechos que postuló:
1. Cada electrón gira alrededor del núcleo en una órbita sin emitir energía radiante alguna.
2. Solamente existen órbitas electrónicas en las que el momento angular del electrón sea un múltiplo entero de la constante de Planck.
3. La absorción o emisión de energía radiante por parte de un átomo se hace mediante un cambio de órbita del electrón, de forma que si emite energía radiante, el electrón salta a una órbita de menor energía, y si absorve energía radiante, entonces salta a una órbita de mayor energía.El radio orbital, la energía y las rayas del espectro de absorción
Bohr postuló, por tanto, que el momento angular del electrón no podría ser cualquiera, sino que habría de ser siempre un múltiplo entero de la constante de Planck:
esta idea, en principio sin ninguna justificación, representó el paso genial que permitió avanzar en la resolución del problema de la inestabilidad del modelo atómico del momento.
Al número cuántico n le llamó "número de la órbita del electrón"; así, n=1 corresponde a la primera órbita, n=2 a la segunda órbita, etc..
El momento angular, pues, habría de estar cuantificado, en paquetes, como lo estaría la misma energía, según la hipótesis de Planck.
Al hacer esta introducción cuántica, el radio de la órbita del electrón se podría expresar de la siguiente manera:
Esta expresión, para la primera órbita (n=1), y considerando el átomo de Hidrógeno (Z=1), nos da:
Este valor,
, es lo que se empezó a llamar "radio de Bohr".
En cuanto a la energía del electrón en la órbita de número cuántico n:
o bien
y siendo
se puede escribir:
Y para la emisión o recepción de energía al saltar el electrón desde una órbita a otra:
Según esto, podríamos calcular en ergios o en electronvoltios la energía necesaria para que el electrón salte de una a otra órbita. En el caso del Hidrógeno (Z=1) sería:
y en electronvoltios:
Sería, por consiguiente, de unos 13,6 eV, la energía necesaria para arrancar de su órbita a un electrón, en concordancia con los datos experimentales que se poseían entonces.
La variación de energía entre dos órbitas quedaría en la expresión:
o bien:
Despejando la frecuencia para el átomo de hidrógeno (Z=1):
y la longitud de onda:
Es decir, aparece la constante que había sido descubierta empíricamente por Rydberg, y que hasta entonces nadie había podido explicar teóricamente:
Las limitaciones básicas del modelo
El modelo atómico que estableció Bohr, aunque explicaba algunos aspectos experimentales de la fisica de su tiempo, no podía enmarcarse dentro de una concepción clara de la mecánica. Parecía, realmente, como el fruto de una mezcla arbitraria entre la mecánica clásica y la incipiente mecánica cuántica que surgía desde la hipótesis de Planck. Esto le hizo blanco de las críticas de muchos científicos de su tiempo, que no admitían sin una adecuada justificación la aceptación de los postulados cuanticos introducidos para poder desarrollar el modelo clásico de Rutherford.Sin embargo, la limitación fundamental, observada desde el primer momento, es que el modelo no explicaba la estructura espectral de otros átomos distintos al hidrógeno, ni tampoco las leyes del enlace químico.
Correcciones sucesivas
Ya en 1916 comenzaron a hacerse correcciones al modelo atómico propuesto por Bohr, a fin de adaptarlo a hechos experimentales, y que consistieron, en principio, en la introducción de nuevos números cuánticos para caracterizar al electrón dentro de la estructura del átomo. Así, se introdujeron en poco tiempo los números cuánticos azimutales, los números cuánticos magnéticos y los números cuánticos de spin.
Carlos S. Chinea
casanchi@teleline.es
12 diciembre 2002
|
|
|
|
Más artículos de Física